富士通Japan株式会社
医療機器の不具合情報を一元管理する新サービス
「パーシヴSafinn/MD」を提供開始
2021年4月の規制変更に対応、医療機器メーカーの業務効率化を支援
富士通Japan株式会社(注1)(以下 富士通Japan)は医療機器メーカーに向けて、自社で製造した医療機器の不具合情報の入力から報告、保管まで一元管理するSaaS型のサービス 「FUJITSU ライフサイエンスソリューション tsClinicalパーシヴSafinn/MD(ティーエスクリニカル パーシヴサーフィンエムディ)」(以下 「パーシヴSafinn/MD」)を4月から提供開始します。
「パーシヴSafinn/MD」は、当社が長年にわたり医薬品メーカー向けに提供してきた医薬品の安全性情報管理システム「tsClinical パーシヴ」(以下 「パーシヴ」)シリーズのノウハウを生かした新サービスです。2021年4月の規制変更(注2)に対応しており、XMLファイルの作成から、伝送、ACK(注3)ファイルの確認までワンクリックで行えます。また、入力の補助や不具合情報のデータベース化、専門のシステムエンジニアによる問い合わせ対応、CSV(Computerized System Validation)(注4)支援などの各種機能とサポートにより、お客様の業務負担を軽減します。
当社は今後も、お客様のニーズにお応えするとともに、医薬品や医療機器の安全性情報管理業務を支援するサービスの提供を通じ、安心・安全な医療の実現に貢献してまいります。
背景
昨今、医療技術の進展は目覚ましく、バイオ医薬品や再生医療など、次世代医療と呼ばれる新たな治療法が次々と実用化されています。医療現場で使用される医療機器も日々進歩していますが、安心・安全な医療を提供するため、これまで以上に高い安全性が求められています。
医療機器メーカーは、自社で製造した医療機器に不具合が発生した際、その情報を独立行政法人医薬品医療機器総合機構(PMDA)へ報告することが薬機法(注5)によって義務づけられています。報告された情報は、専門的観点から分析、評価され、必要な安全対策を講じるために利用されています。
従来の不具合報告において、医療機器メーカーの担当者は、PMDAに対して所定フォーマットの報告書を紙で郵送するか、Word形式の報告書を添付し、e-Gov電子申請(注6)で報告していました。しかし、2021年4月の規制変更により、医薬品の不具合報告と同様、XMLファイルを用いた報告が義務化されました。義務化にあたり、PMDA から「医療機器不具合等報告XMLファイル作成ツール」が提供されることになりましたが、医療機器メーカーがこのツールを使用して報告する場合、連絡票の手入力、暗号化・復号化作業の業務負荷や作業の正確性とともに、報告履歴の管理などが課題になると考えられていました。
当社は、1995年に医薬品メーカーに対して医薬品の安全性情報管理システム「パーシヴ」シリーズを発売し、累計80社以上の医薬品メーカーに利用されています。この実績を踏まえ、従来から、一部の医療機器メーカーのお客様より「パーシヴ」のような不具合情報の管理サービスを医療機器分野においても提供してほしい、という要望が寄せられていました。
今回発表する「パーシヴSafinn/MD」は、これまで当社が長年にわたり医薬品業界トップシェアのサービス展開で培った経験とノウハウを生かして提供する、医療機器メーカー向けの新たなSaaS型サービスです。自社で製造した医療機器の不具合情報の入力から報告、保管までの一元管理を実現します。2021年4月の規制変更に対応しており、ワンクリックで報告書のXMLファイル作成から、伝送、ACKファイルの確認まで行うことができます。不具合情報を入力する際、マスタ機能による予測変換や自動補填機能で入力を支援し、追加報告が必要な際には、過去情報を引き継いだ状態からの入力も可能なため、入力ミスや作業負荷を軽減できます。また、申請された情報はデータベース化されており、蓄積されたデータから不具合情報を検索することも可能です。さらに、当社専門のシステムエンジニアによる問い合わせ対応やアフターフォロー、CSV(Computerized System Validation)のための支援も行っており、導入当初はもちろん、今後の規制要件への対応も含め、将来にわたり安心して利用できます。
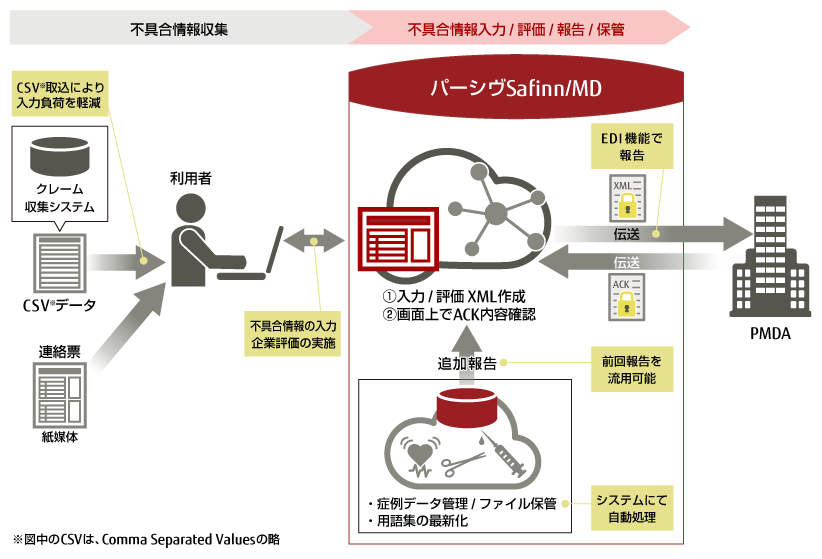 「パーシヴSafinn/MD」サービスイメージ |
特長
- お客様の作業負担を軽減するマスタ管理
マスタ機能により予測変換や自動補填が行われるため、入力ミスや作業負荷が軽減されます。また、不具合用語集は自動で更新されるため、個別に手動で更新する必要はありません。 - シンプルでスピーディーな運用を実現する報告管理
ワンクリックでXMLファイルの作成、報告からACKファイルの確認まで可能です。2021年4月の規制変更への対応はもとより、シンプルでスピーディーな運用を実現できます。 - 不具合情報の活用を可能にするデータベース
蓄積されたデータから過去の不具合情報を検索することが可能です。また、過去の症例一覧の作成や傾向分析のためにデータを活用することができます。 - 円滑な運用を支援する各種サポート
当社の専門のシステムエンジニアが問い合わせ対応、アフターフォローを行います。またCSV(Computerized System Validation)に向けても、当社独自のひな型提供をはじめ、お客様のニーズに合わせた支援が可能です。
機能
| 機能 | 概要 |
|---|---|
| 1.不具合情報・評価情報入力機能 | ・当局報告項目/症例情報項目/管理項目の入力
・必須項目の論理チェック、報告に必要な要件のチェック ・オートコンプリートによる入力補填 |
| 2.版数管理機能 | ・報告単位に版数として症例を管理することが可能 |
| 3.期限管理機能 | ・不具合情報ごとに報告期限および進捗状況を一覧で確認 |
| 4.マスタ管理機能 | ・医療機器、不具合用語集などを管理 |
| 5.セキュリティ・監査証跡機能 | ・ユーザごとの権限(更新・参照など)設定
・ログイン/ログアウトなどの操作履歴、症例データ更新履歴の取得 |
| 6.帳票出力機能 | ・「医療機器不具合・感染症症例報告書」の出力が可能 |
| 7.外部データ取込機能 | ・クレーム受付システムなどからのCSV(Comma Separated Values)ファイルの取込 |
| 8.EDI機能 | ・不具合報告の当局へのXMLファイル送信、ACKファイル受信 |
販売価格、および提供開始時期
内容 | 販売価格(税抜) | 提供開始時期 |
|---|---|---|
| 初期費用 | 個別見積
| 2021年4月 |
| 月額費用 | ※1万円から40万円
|
販売目標
販売開始から3年で35社
富士通Japanについて
富士通Japanは、2020年10月1日に富士通グループのパーパス「イノベーションによって社会に信頼をもたらし、世界をより持続可能にしていく」を国内市場において具現化する中核会社として発足いたしました。豊富なノウハウを生かしたソリューション・SI、パッケージの開発から運用までの一貫したサービスの提供、AIやクラウドサービス、ローカル5Gなどを活用したDXビジネスを推進することにより、お客様に提供する価値を最大化し、持続可能な社会づくりに貢献していきます。
関連Webサイト
・医療機器不具合情報管理サービス FUJITSU ライフサイエンスソリューション tsClinical パーシヴSafinn/MD
・安全性情報管理システム FUJITSU ライフサイエンスソリューション tsClinical パーシヴAce/PV
商標について
記載されている製品名などの固有名詞は、各社の商標または登録商標です。
注釈
- 注1
- 注2規制変更:
「医薬品等の副作用等の報告について」の一部改正について(薬生発0131第5号)により、2021年4月から、医療機器不具合情報はXMLファイルを用いた報告が義務化(2020年4月施行、1年間猶予期間)。 - 注3ACK:
二者間の通信で相手に肯定的な応答を返す際に送られる信号やデータ。正常に受信した旨を伝達するために用いられる。 - 注4CSV(Computerized System Validation):
コンピュータシステムが利用者の意図したとおりに正しく機能することを確実に確認した証拠を文書化すること。ライフサイエンス分野では、コンピュータシステムを使い、データや記録を作成・保管するために求められる。 - 注5薬機法:
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和35年法律第145号)。 - 注6e-Gov電子申請:
各府省が所管する様々な行政手続について、インターネットを利用し自宅や会社のパソコンを使って申請・届出を行えるようにするもの。
本件に関するお客様のお問い合わせ先
富士通Japan株式会社 お客様総合センター
![]() TEL:0120-835-554
TEL:0120-835-554
受付時間 9時~12時、13時~17時30分(土曜日・日曜日・祝日ほか当社休業日を除く)
プレスリリースに記載された製品の価格、仕様、サービス内容、お問い合わせ先などは発表日現在のものです。その後予告なしに変更されることがあります。あらかじめご了承ください。
