中分子創薬における環状ペプチドの安定構造探索
シミュレーションを高精度かつ高速化する技術を開発
「デジタルアニーラ」とHPC技術により創薬の探索時間が1/2に短縮!
2022年3月29日

近年、新型コロナウイルス感染症など、未知のウイルスによる爆発的な感染症の拡大が社会問題となっています。これら感染症に対する新薬開発の期間削減やコスト低減が求められています。
富士通は、新薬の候補化合物などを、より高速に探索する技術の研究を進めています。
今回、環状ペプチドによる中分子創薬において、組合せ最適化問題を高速に解く当社独自の量子インスパイアード技術である「デジタルアニーラ」による高精度初期解生成技術と、計算効率を高めた高速MD(分子動力学)計算技術を開発することで、今まで12時間かかっていた新薬の候補化合物となる高精度な環状ペプチドの安定構造探索が、半分の6時間で実施できることを確認しました。
これにより、複数の構造情報が得られるため、ウェット実験*1による医薬候補物質絞り込みの短期間化が期待されます。
従来の課題
新薬開発の期間削減やコストを低減するには、有効な化合物を多数の候補物質群の中から早期に絞り込むことが重要となります。医薬候補物質の構造を計算機上で特定することは、薬効を確認するウェット実験の時間短縮に有効と考えられます。
現状、大きさがアミノ酸2~3個程度の低分子候補物質では、計算機を用いた絞り込み技術の一部は実用化されています。しかし、副作用の低減が見込まれる、アミノ酸5~50個となる中分子候補物質では、計算機を用いた絞り込みが困難という課題がありました。
この課題に対して富士通は、組合せ最適化問題に向けた量子インスパイアード技術である「デジタルアニーラ」とハイパフォーマンス・コンピューティング(以下、HPC)技術を組み合わせ、実用的な時間で候補化合物の絞り込みを可能にする技術を開発してきました。
今までの技術*2では、はじめにペプチドをアミノ酸残基ごとに一つのまとまりとして粗く捉えた構造(粗視化モデル)を作成し、「デジタルアニーラ」で安定となる最適な構造を計算することで、アミノ酸残基の安定配置を算出します。次に、得られた安定配置の粗視化モデルを全ての原子からなる構造(全原子モデル)に戻し、これを初期解としてHPCを用いたMD計算(原子や分子の物理的な動きのコンピュータシミュレーション手法)によりペプチドの安定構造を探索します。
この手法により、新薬の候補化合物となる中分子レベルの環状ペプチドの安定構造探索を12時間で完了させることに成功しています。
しかし、新たなウイルスの発生などによる新薬開発に対応していくには、さらなる高精度、高速化が必要です。
開発した技術
今回、創薬プロセス全体の効率化を進めるため、薬効を発現する可能性が高い候補化合物をより短時間で推定できるように、安定構造探索の高精度化とMD計算を高速化する技術を開発しました。
開発した技術は、新しい粗視化モデルを「デジタルアニーラ」に適用することにより、安定構造探索のさらなる高精度化を実現する高精度初期解生成技術と、計算時間の最大のボトルネックになっていたMD計算を高速化する、計算効率を高めた高速MD計算技術の二種類から構成されます。
1.新しい粗視化モデルの導入による高精度初期解生成技術
従来の粗視化モデルは、アミノ酸残基間の距離に応じた相互作用ポテンシャルのみを考慮していました。今回さらに、アミノ酸残基の隣接する三点間で構成される面同士の角度である二面角などの結合情報を取り込んだ高精度粗視化モデルを開発しました。
これを用いて「デジタルアニーラ」で求解することで、高精度な粗視化解を算出することができます。
「デジタルアニーラ」が出力する高精度な粗視化解をHPCによるMD計算の初期値として入力することで、ウェット実験から得られる実構造と比べた計算結果の誤差を従来に比べ25%低減できました。
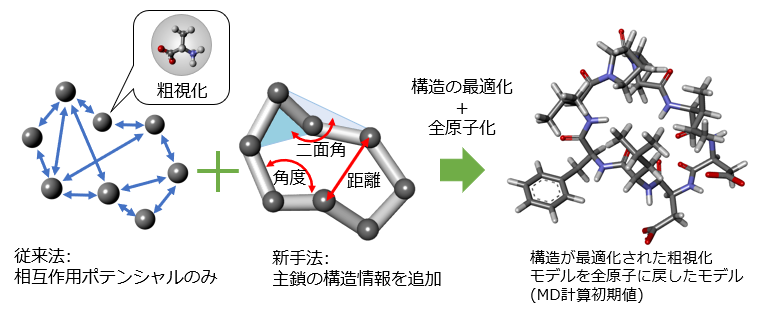 図1:新しい粗視化モデルのDA適用による高精度初期解生成技術
図1:新しい粗視化モデルのDA適用による高精度初期解生成技術
2.計算効率を高めた高速MD計算技術
創薬プロセスでは、多数の候補化合物についてMD計算を行いますが、各候補化合物のMD計算には様々なタスクの処理が含まれ、それらを効率良く動作させることが重要となります。各タスクが必要とする計算のリソース量は異なり、単一のタスクがプロセッサ全体を使い切れない場合、プロセッサコアの利用率は低下します。
一つのプロセッサで単純に複数のMD計算を行う場合、従来の方法では複数のMD計算が完全に並列動作せず、各MD計算を行うごとに切り替え処理が発生しオーバーヘッドとなります。また、プロセッサの一部を各候補に関するMD計算に固定で割り当てる場合、プロセッサコアの利用率で一定の改善を得られますが、必要リソース量が少ないタスクを実行する際のコアの利用率は低いままとなってしまいます。
そこで、MD計算の詳細な動作解析と性能分析を基に、複数のMD計算を同時に実行できるように不均一なタスク群を適切にプロセッサコアに割り当てて並列動作させることによって、コア利用率を最大化する技術を開発しました。本技術によって、多くのリソースを要求するタスクと少ないリソースでも効果的に動作するタスクを、プロセッサコアの利用率を高めた状態で並列に動作させることが可能となり、多数の候補物質に関するMD計算の時間を半分にすることができました。
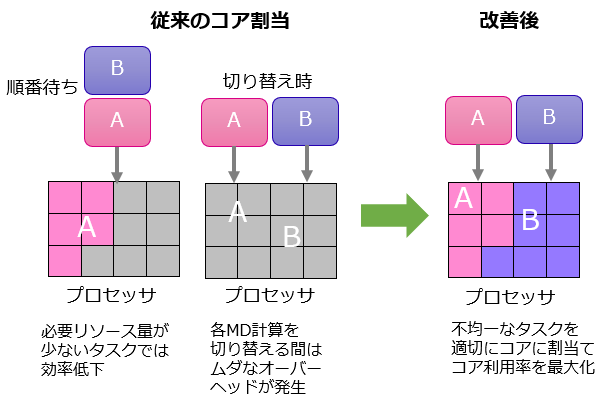 図2 プロセッサ使用効率を高めた高速MD計算技術
図2 プロセッサ使用効率を高めた高速MD計算技術
上記の2つの開発技術を、中分子創薬のターゲットである環状ペプチド構造を有する候補化合物の安定状態を評価するシミュレーションに適用しました。その結果、約2200個の原子数の1回のシミュレーションにおいて、最安定構造に対する誤差が0.16ナノメートルから0.06ナノメートルに改善した安定構造を、従来の半分のシミュレーション時間で得ることができました。今までは12時間かかっていたものが6時間に短縮されます。これにより、高精度な中分子創薬の新規薬物の候補の絞り込みの加速が期待されます。
今後について
富士通は、「デジタルアニーラ」とHPCを活用する本技術を様々な新薬候補化合物に適用することにより、中分子創薬の開発を時短化し、医療分野における社会問題の解決に貢献することを目指します。
■開発者コメント
ICTシステム研究所、デジタルアニーラ事業部 開発チームメンバー

小山 純平

片山 健太朗

長坂 侑亮

眞鍋 敏夫
昨今の新型コロナウイルス感染症など、創薬に対する社会のニーズが高まっていると感じています。我々のプロジェクトでは、「デジタルアニーラ」とHPCを活用することによって社会問題を解決していくことを目指しています。今回、開発した技術は、創薬プロセスを短縮するものです。薬が最終的に患者の方へ届くまでの時間を少しでも短くするための一助になればと思い研究をしてきました。これからも、テクノロジーで社会課題を解決する研究開発を進めていきます。
注釈
*1 ウェット実験:実験室で行う実験。計算機による実験と対をなす。
*2 今までの技術:富士通とペプチドリーム、高速かつ高精度に中分子医薬品候補化合物の探索を実現![]() (2020年10月13日プレスリリース)
(2020年10月13日プレスリリース)
本件に関するお問い合わせ
fj-labs-inov-dd-pd@dl.jp.fujitsu.com
EEA (European Economic Area) 加盟国所在の方は以下からお問い合わせください。
Ask Fujitsu
Tel: +44-12-3579-7711
http://www.fujitsu.com/uk/contact/index.html![]()
Fujitsu, London Office
Address :22 Baker Street
London United Kingdom
W1U 3BW



