製薬業界向け tsClinical 臨床試験(治験)・製造販売後ソリューション
富士通は、臨床試験(治験)、医薬品の安全管理、医薬品の製造販売後調査に関わる業務を支援するソリューションをご提供します。
臨床試験(治験)・製造販売後ソリューション体系図
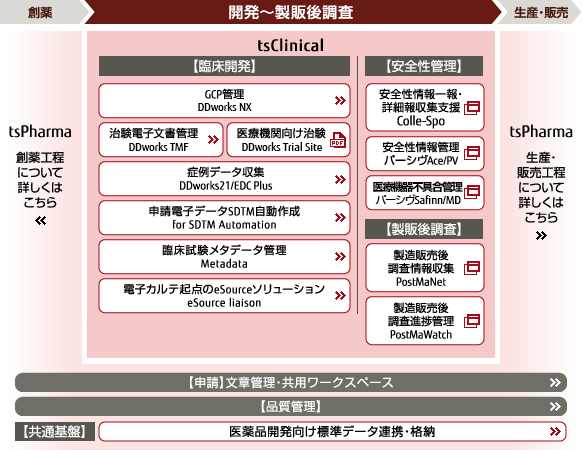
臨床試験(治験)ソリューション
臨床試験向けGCP管理システム tsClinical DDworks NX
DDworks NXは臨床試験を実施する全ての製薬企業と医療機関を”つなぎ”、治験関連文書のデジタル化、Clinical QMS(QbD)促進により、臨床試験業務の効率化に貢献します。
臨床試験(治験)業務の実施計画立案から終了手続きまで、業務遂行する上で重要な、「プロセス管理」、「レコード管理」、「エビデンス管理」などの各種マネジメントを高い質で実行することを可能とするための、様々な優れたレギュレーションチェック機能を提供します。
治験電子文書管理システム tsClinical DDworks TMF
日本の治験関連文書電子化(eTMF化)の実現に寄与します。DDworks NXを含めた文書点検/記録確認の効率化、文書授受記録可視化によるモニタリング報告書労力の軽減、電子申請に向けたTMFリファレンスモデルへのマッピング機能など、査察においても豊富な実績を持つDDworks NXのオプション製品として提供します。
医療機関向け治験 tsClinical DDworks Trial Site
DDworks Trial Siteは、治験を実施する医療機関と新薬開発を行う製薬企業との間においてやり取りされる治験文書をクラウド上で共通管理することができるSaaS型ソリューションです。
臨床試験向け症例データ収集システム tsClinical DDworks21/EDC plus
臨床試験向け症例データ収集システム tsClinical DDworks21/EDC plusは、臨床試験(治験)データの収集(EDC業務)および臨床試験(治験)データの管理(CDMS業務)を、必要な期間(臨床試験期間のみ)だけご利用いただける、ASP型のシステムです。
申請電子データSDTM自動作成システム tsClinical for SDTM Automation
申請電子データSDTM自動作成システム tsClinical for SDTM Automationは、臨床試験の申請データをCDISC標準のSDTM形式で自動作成するシステムです。様々なソースデータから作成されるSDTMデータの作成業務の効率化とコスト削減を実現します。
電子カルテ起点のeSourceソリューション tsClinical eSource liaison
電子カルテ起点のeSourceソリューションtsClinical eSource liaisonは、医療機関の電子カルテ内に存在する原データをCertified Copyし、製薬企業のEDC/CDMSへ転送・取り込み可能なCDISC-ODM形式で出力するソリューションです。
安全管理ソリューション
安全性情報一報・詳細報収集支援システム tsClinical Colle-Spo
安全性情報一報・詳細報収集支援システム tsClinical Colle-Spoは、製薬企業が従来、紙や人力で収集していた医薬品の副作用情報に関する自発報告の収集業務を電子化するSaaS型サービスです。MR入力による連絡票(一報)から医師入力による詳細調査(詳細報)までをインターネットを介して収集することで情報一元管理と作業負荷軽減を強力にサポートします。
安全性情報管理システム tsClinical パーシヴAce/PV
安全性情報管理システム tsClinical パーシヴAce/PVは、医薬品安全性情報の収集から報告、保管までの一元管理を実現します。各種機能により、安全性情報管理業務の規制を遵守(GVP)、業務効率化を強力サポートします。
医療機器不具合管理 tsClinical パーシヴSafinn/MD
従来、医療機器メーカーが紙で管理、報告していた医療機器の不具合情報を電子的に管理し、PMDAに報告するSaaS型サービスです。本サービスでは、連絡票(紙・メール)やクレーム受付システム等を経由してデータの入力または取込みを行うことで入力負荷を軽減します。また、不具合に対する報告要否などの評価を実施し、報告に該当するものに対して報告書(XMLファイル)を作成することが可能です。
製造販売後調査ソリューション
製造販売後調査データ収集システム tsClinical PostMaNet
製造販売後調査データ収集システム tsClinical PostMaNetは、医薬品の製造販売後調査における症例データを、インターネットを介して医療機関から製薬企業に送信し、データの収集・管理をするASPサービスです。
製造販売後調査進捗管理システム tsClinical PostMaWatch
製造販売後調査進捗管理システム tsClinical PostMaWatchは、製造販売後医薬品の有効性や安全性に関わる調査(PMS)の情報データと進捗を管理するASPサービスです。管理部門を中心として行われてきたPMS業務について、現場の最前線であるMRからの入力、およびCROからの利用を可能にし、業務の効率化・迅速化を図ります。