- データインテグリティ対応への取り組み
-
CDISC対応への取り組み
- CDISCとは
-
CDISC関連発表資料
- メタデータ管理システムにおけるTherapeutic Area Data Standardsの実装方法 ~TAUG for Chronic Hepatitis C Virus Infection V1.0 (Provisional) ~
- CDISC Japan Interchange 2016 Using SHARE API
- CDISC Japan Interchange 2016 - Submitting Study Data via Gateway
- メタデータ管理システムにおけるTherapeutic Area Data Standardsの実装方法 ~TAUG for Virology V2.0(Provisional)~
- メタデータ管理システムにおけるTherapeutic Area Data Standardsの実装方法 ~TAUG for QT Studies V1.0(Provisional)~
- メタデータ管理システムにおけるTherapeutic Area Data Standardsの実装方法 ~TAUG for Cardiovascular Studies V1.0(Provisional)~
- PhUSE Single Day Events(SDE)
- CDISC Japan Interchange
- CDISC Asia-Pacific Interchange
- CDISC関連ツールダウンロード
- TSVファイル作成ツールダウンロード
- MRの将来性と「地域包括ケアシステム」
- ホワイトペーパー
- ソリューションのご紹介
- 導入事例
- イベント・セミナー
- お問い合わせ
- 過去のお知らせ
CDISC関連発表資料
臨床研究データの世界的な業界基準「CDISC」に関する富士通の取り組みについての資料をご紹介します。
CDISC関連発表資料 一覧
資料のタイトルをクリックすると詳細をご覧いただけます。
メタデータ管理システムにおけるTherapeutic Area Data Standardsの実装方法 ~TAUG for Chronic Hepatitis C Virus Infection V1.0 (Provisional) ~
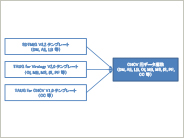 本稿は”Therapeutic Area Data Standards User Guide for Chronic Hepatitis C Virus Infection V1.0 (Provisional)”(以降、TAUG for CHCV)をメタデータ管理システムに実装する際の方法をまとめたものである。
本稿は”Therapeutic Area Data Standards User Guide for Chronic Hepatitis C Virus Infection V1.0 (Provisional)”(以降、TAUG for CHCV)をメタデータ管理システムに実装する際の方法をまとめたものである。
CDISC Japan Interchange 2016 Using SHARE API
SHARE APIを活用したTherapeutic Area Data Standards User Guide (TAUG)の実装
CDISC Japan Interchange 2016 - Submitting Study Data via Gateway
Gatewayを経由した申請電子データの提出
 About PMDA Gateway
About PMDA Gateway
Application Flow using Gateway
Submitting study data via Gateway
PMDA Gatewayとは
Gatewayを使った申請の流れ
Gatewayを経由した試験データの提出
メタデータ管理システムにおけるTherapeutic Area Data Standardsの実装方法 ~TAUG for Virology V2.0(Provisional)~
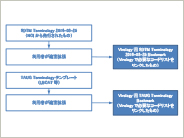 本稿は“Therapeutic Area Data Standards User Guide for Virology V2.0(Provisional)”(以降、TAUG for Virology)をメタデータ管理システムに実装する際の方法をまとめたものである。
本稿は“Therapeutic Area Data Standards User Guide for Virology V2.0(Provisional)”(以降、TAUG for Virology)をメタデータ管理システムに実装する際の方法をまとめたものである。
メタデータ管理システムにおけるTherapeutic Area Data Standardsの実装方法 ~TAUG for QT Studies V1.0(Provisional)~
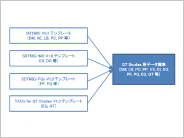 本稿は“Therapeutic Area Data Standards User Guide for QT Studies V1.0(Provisional)”(以降、TAUG for QT Studies)をメタデータ管理システムに実装する際の方法をまとめたものである。
本稿は“Therapeutic Area Data Standards User Guide for QT Studies V1.0(Provisional)”(以降、TAUG for QT Studies)をメタデータ管理システムに実装する際の方法をまとめたものである。
メタデータ管理システムにおけるTherapeutic Area Data Standardsの実装方法 ~TAUG for Cardiovascular Studies V1.0(Provisional)~
 本稿は“Therapeutic Area Data Standards User Guide for Cardiovascular Studies V1.0(Provisional)”(以降、TAUG for Cardiovascular Studies)をメタデータ管理システムに実装する際の方法をまとめたものである。
本稿は“Therapeutic Area Data Standards User Guide for Cardiovascular Studies V1.0(Provisional)”(以降、TAUG for Cardiovascular Studies)をメタデータ管理システムに実装する際の方法をまとめたものである。
PhUSE Single Day Events(SDE)
CDISCを用いた臨床治験におけるメタデータ管理の重要性について
 Why is effective Metadata Management the key?
Why is effective Metadata Management the key?
Because all of these "labor-intensive" processes are related to Metadata.
Managing Metadata effectively ensures everyone maps source data to SDTM in the same discipline.
Besides, it ensures metadata traceability between your EDC database, SDTM, and ADaM.
なぜメタデータ管理が重要なのか?
それは労働集約型のプロセスがすべてメタデータに関連しているからである。
メタデータを効果的に管理することによって、誰でも同じ基準でSDTMのデータマッピングが可能となる。
さらに、メタデータ管理をすることでEDCデータベースとSDTM、ADaMのトレーサビリティを確保することが可能となる。
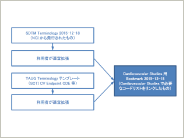
CDISC Japan Interchange
SDTMを市販後調査に適用するための実証実験について
 Can SDTM be applied to post-marketing studies similarly to clinical studies?
Can SDTM be applied to post-marketing studies similarly to clinical studies?
How is Reliability and Trustworthiness of Records?
Furthermore, how is Cost Effectiveness?
SDTMは市販後調査に適用できるのか?
また記録の確実性、信頼性は?
さらに、コストへの効果はどうなるのか?
CDISC Asia-Pacific Interchange
「SDTMを活用した臨床データと安全性情報の統合検証」および「診療情報とEDC連携 概念検証」について
- Clinical & Safety Data Integration using SDTM
- EDC-EMR Bridging POC
事例紹介:
- SDTMを活用した臨床データと安全性情報の統合検証
- EDCと診療情報の連携 概念検証
CDISC関連情報
![]() 富士通ではCDISC関連ツール(Define.xmlを作成するツール)を無料で公開しています。
富士通ではCDISC関連ツール(Define.xmlを作成するツール)を無料で公開しています。
CDISC関連ツールダウンロード
tsClinical Define.xml Generator(最新バージョン)が入手できます
- CDISC SDTMおよびADaMデータセットのメタデータを記載したExcelファイルをもとにdefine.xmlを生成します(SENDも対応予定)。
- 指定したXML Schemaに対してdefine.xmlを検証します。
![]() 臨床試験のメタデータ管理を効率化する「CDISC準拠 臨床試験メタデータ管理システム tsClinical Metadata」を30日間無料でお試しいただけます。
臨床試験のメタデータ管理を効率化する「CDISC準拠 臨床試験メタデータ管理システム tsClinical Metadata」を30日間無料でお試しいただけます。
tsClinical Metadata 30日間無料トライアル
 30日間無料トライアルは「
富士通WEB MART forクラウド
30日間無料トライアルは「
富士通WEB MART forクラウド![]() 」からのお申し込みとなります。
」からのお申し込みとなります。
CDISC準拠 臨床試験メタデータ管理システム tsClinical Metadata
![]() 臨床試験のメタデータ管理を効率化し、新薬電子申請で必要となるCDISC標準に準拠したデータ作成を容易にするメタデータ管理システムです。
臨床試験のメタデータ管理を効率化し、新薬電子申請で必要となるCDISC標準に準拠したデータ作成を容易にするメタデータ管理システムです。
メタデータ管理の重要性
![]() 従来の労働集約型のCDISC適用業務モデルと、効果的なメタデータ管理を実現した新業務モデルの違いと生産性についてご紹介します。
従来の労働集約型のCDISC適用業務モデルと、効果的なメタデータ管理を実現した新業務モデルの違いと生産性についてご紹介します。
| CDISC対応への取り組み | CDISCとは | CDISC関連発表資料 | CDISC関連ツールダウンロード |