CDISC準拠 臨床試験メタデータ管理システム tsClinical Metadata

CDISC準拠 臨床試験メタデータ管理システム tsClinical Metadataは、臨床試験のメタデータ管理を効率化し、新薬電子申請で必要となるCDISC標準に準拠したデータ作成を容易にするメタデータ管理システムです。
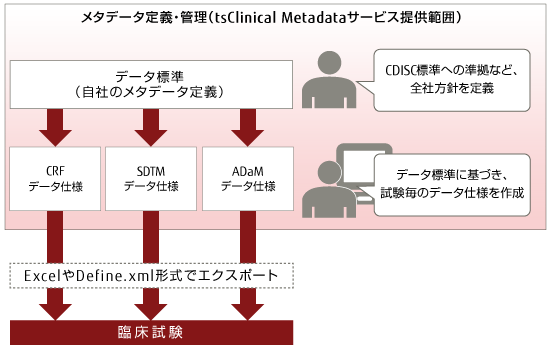
CDISC仕様や用語および自社ガイドラインを管理し、それらを元に各臨床試験のCRF, SDTM, ADaM, Define.xmlのデータ仕様を定義することができます。
注) 30日間無料トライアルは「富士通WEB MART forクラウド![]() 」からのお申し込みとなります。
」からのお申し込みとなります。
CDISC準拠 臨床試験メタデータ管理システム tsClinical Metadataの特長
臨床試験業務におけるメタデータの定義・管理で業務の効率化を実現
CDISC準拠 臨床試験メタデータ管理システム tsClinical Metadataは、臨床試験業務における全社単位に定義したメタデータ「データ標準」、およびこれらに基づいて作成した試験単位のメタデータ「データ仕様」を一元的に管理できます。
- 臨床試験担当者は、自社で定義した「データ標準」を活用し、試験単位のメタデータ「データ仕様」を作成することで、業務の効率化を実現
- 自社の「データ標準」と臨床試験毎のメタデータ定義「データ仕様」を一元的に管理
- 経験によって精度がばらつく「データ仕様」を、「データ標準」をベースに作成することで、どの臨床試験担当者でも一定以上の品質で作成
最新のCDISC標準を自動取り込み、メタデータへの反映も容易
CDISC準拠 臨床試験メタデータ管理システム tsClinical Metadataは、最新のCDISC標準を自動取り込み、管理できます。以前のCDISC標準との差分が一目で確認できるため、臨床試験中の「データ仕様」にも変更差分が容易に反映できます。
また、自社の臨床試験に必要な独自のドメイン・変数も合わせて管理できます。
- 臨床試験の途中でCDISC標準のバージョンが変わった場合も、変更時期や最新バージョンとの差異を一目で確認できるため、新薬申請時に活用可能
- CDISC標準に対し、自社の臨床試験で必要となる新しいドメインや変数を独自に追加したり、不要な定義の削除が可能
CDISC Controlled Terminologyをベースとした自社独自の用語定義が可能
CDISC準拠 臨床試験メタデータ管理システム tsClinical Metadataは、NCIが発行しているCDISC Controlled Terminologyを取り込み、自社で必要な用語を追加することで、自社独自の用語定義を作成・管理できます。これを活用することで、全社で用語定義の統一が図れます。CDISC Controlled Terminologyは日本語同義語を合わせて取り込むため、日本語での検索も容易です。
- NCI発行のCDISC Controlled Terminologyを日本語同義語と合わせて取り込み、管理
- 日本語同義語が割り当てられているため、用語の日本語検索が可能
- CDISC Terminologyに加え、自社の臨床試験で利用する用語の追加登録・編集、不要な用語定義の削除により、自社独自の用語定義が作成可能
- 用語定義を活用することで、全社で用語定義の統一が可能
- 用語定義変更履歴や過去のバージョンとの差異が管理できるため、新薬申請時に有用
CDISC準拠 臨床試験メタデータ管理システム tsClinical Metadataの機能
基本サービスをご契約いただくと、以下の6つの基本機能をご利用いただけます。
【基本機能】
- CDISC標準の管理、および自社独自の「データ標準」作成・管理機能
- メタデータ管理に使用する用語の管理機能
- 個々の臨床試験の「データ仕様」の作成・管理機能
- ユーザー管理機能
- マスターデータ管理機能
- ログイン履歴機能

tsClinical Metadata 30日間無料トライアル
臨床試験のメタデータ管理を効率化する、CDISC準拠 臨床試験メタデータ管理システム tsClinical Metadata 30日間無料トライアルを30日間無料でお試しいただけます。
注) 30日間無料トライアルは「富士通WEB MART forクラウド![]() 」からのお申し込みとなります。
」からのお申し込みとなります。
関連情報
メタデータ管理の重要性

従来の労働集約型のCDISC適用業務モデルと、効果的なメタデータ管理を実現した新業務モデルの違いと生産性についてご紹介します。
CDISC対応への取り組み
CDISC(臨床試験のデータ標準)に関する富士通の取り組みや、CDISC関連発表資料や関連ソリューションのご紹介、CDISC関連ツール(Define.xml)を公開しています。