申請電子データSDTM自動作成システム
tsClinical for SDTM Automation
申請電子データSDTM自動作成システム tsClinical for SDTM Automationは、医薬品申請における臨床試験の申請電子データをCDISC標準のSDTM形式で自動作成するシステムです。
EDCやその他外部データといった様々なソースデータから作成されるSDTMデータの作成業務の効率化とコスト削減を実現します。
申請電子データSDTM自動作成システム
tsClinical for SDTM Automationの特長
富士通は臨床試験データ申請までの業務において、SDTMを見据えた試験デザイン・eCRFの構築から申請電子データ作成までのプロセスをトータルで支援します。
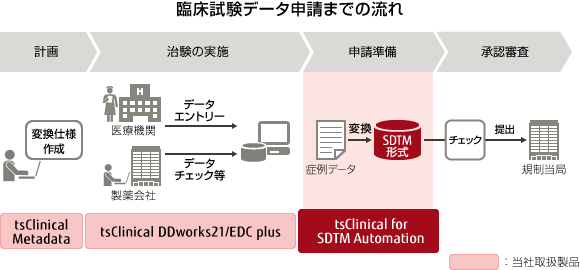
SDTMデータ作成ツールとして単独での提供が可能
富士通製のEDCシステムtsClinical DDworks21/EDC plus以外のEDCシステムで収集されたデータにも対応可能なため、現在使用しているEDCシステムに制限されることなく、本システム単体での導入が可能です。また、EDCデータ以外にも、臨床検査データやePRO等の外部機関で収集されたデータにも幅広く対応しております。
尚、対応可能なEDCシステム、外部データの詳細につきましては別途お問合せください。
CDISCが定める標準SDTM Implementation Guide(SDTM IG)に準拠した形式で出力
各社作成した変換仕様書とEDCデータ等の変換元となるソースデータから、SDTM IGに準拠した形式であるDataset、aCRFを出力します。また、メタデータ管理システムtsClinical Metadataと連携することにより、変換仕様書とDefine-XMLの作成、管理が行え、品質の均一化を図ることができます。これらシステムを、CDISC標準規約の知識や、申請電子データのアセスメント経験を豊富に持つスタッフが導入を支援します。
プログラミングレスによるSDTMデータ作成業務の効率化・コスト削減を実現
各社標準となる変換仕様書をベースに、システム上で試験毎の変換仕様書を作成するだけでSDTMデータの作成が可能になるため、従来、手作業で行っていた各種作成、確認作業が削減され、コスト減を実現します。
- プログラムレスになるため、変換プログラムの作成やプログラムレビュー、検証(ダブルプログラミング)等が不要
- トレーサビリティが担保できるため、規制当局(PMDA)からの査察対応や照会対応の効率化が可能
関連情報
tsClinical for SDTM Automationは富士通の特許製品です。
CDISC対応への取り組み
臨床研究データの世界的な業界基準「CDISC」に関する富士通の取り組みをご紹介します。
富士通は2012年12月にCDISC Platinumメンバーとして加入し、CDISC標準に関して国内市場ではIT業界随一の経験・人員を有しています。
CDISC準拠 臨床試験メタデータ管理システム tsClinical Metadata
CDISC準拠 臨床試験メタデータ管理システム tsClinical Metadataは、臨床試験のメタデータ管理を効率化し、新薬電子申請で必要となるCDISC標準に準拠したデータ作成を容易にするメタデータ管理システムです。
臨床試験向け症例データ収集システム tsClinical DDworks21/EDC plus
臨床試験向け症例データ収集システム tsClinical DDworks21/EDC plusは、臨床試験(治験)データの収集(EDC業務)および臨床試験(治験)データの管理(CDMS業務)を、必要な期間(臨床試験期間のみ)だけご利用いただける、ASP型のシステムです。