CDISC準拠 臨床試験メタデータ管理システム tsClinical Metadata メタデータ管理の重要性
従来の労働集約型のCDISC適用業務モデルと、効果的なメタデータ管理を実現した新業務モデルの違いと生産性についてご紹介します。
メタデータ管理の概念
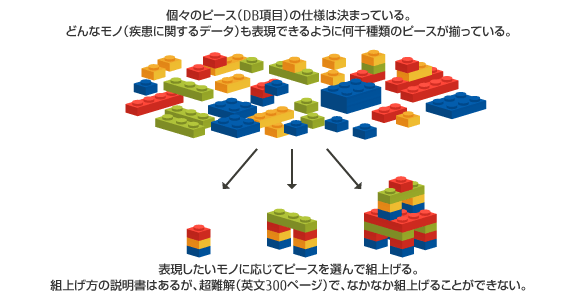
CDISCは、非常に複雑なブロックやパズルに例えることができます。
既存の「労働集約型」でCDISC適用業務を行う場合
効果的なメタデータ管理を行っていない場合、CDISC適用業務において、次のようなリスクが生じる可能性があります。
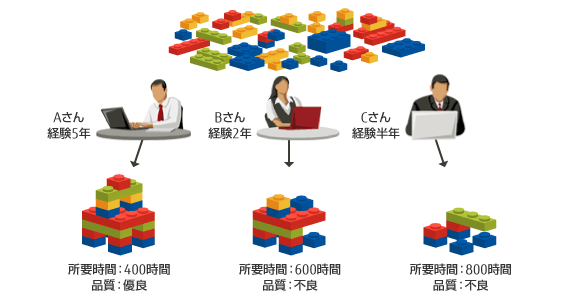
CDISCを適用するには、ユーザが各種業務システムのDBをCDISC仕様に設定する必要があります。しかし英文で約300ページからなるCDISC仕様の理解に多大な時間を要し、人により理解が異なる・理解を間違うリスクに加え、担当者の経験・スキルの差により成果物の品質にばらつきが生じます。
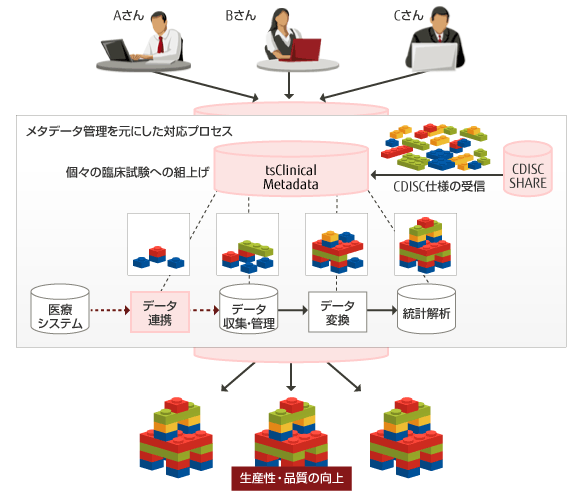
生産性の高いメタデータ管理システムを取り入れた業務の場合
CDISC適用のメリットを得るには、CDISCの「ピース」を管理し、個々の臨床試験用に「組上げ」るプロセスを容易にするメタデータ管理システムが必須となります。
| 業務課題・背景 | CDISC準拠 臨床試験メタデータ管理システムが提供する価値 |
|---|---|
| 様々な臨床試験・疾患に応じてCDISCの利用者が応用して利用しなければならない。 |
組織内でCDASH/SDTM/ADaM/Define.xmlおよびTherapeutic Area Standardsの実装方針を再利用可能な形で共有し、組織として一貫したCDISCの実装を促し、臨床試験データの作成効率と再利用性を高めます。 |
| CDISCは複雑な標準であり、また発展途上中で頻繁に更新されるため、CDISCの利用者が更新内容を追随することは容易ではない。 |
CDISC SHAREの配信する定義情報をインポートでき、正確なCDISCの定義を組織内で再現します。また、各バージョン間の差異を可視化し、新しいバージョンへの適用を容易にします。 |
| CDISCの仕様は全て英語で記載されており、言語の壁のあるCDISC利用者が学習することは容易ではない。 |
メタデータ作成時に入力されたデータを自動チェックし、CDISC標準への準拠を助けます。またローカル言語(日本語等)の説明を管理し、組織内でのナレッジの蓄積を支援します。 |
| パートナーや担当者ごとにCDISCの実装方法が異なり、各臨床試験データの形式が均一にならない。 |
パートナーを含めた各臨床試験の関係者が、一元的に管理されたメタデータにアクセスすることにより、異なる組織間でのコミュニケーションとデータの均一化を促進します。 |
| 現状ではSDTM/ADaM/Define.xmlの作成は労働集約型作業のためかなりのコストが発生してしまい、 CDISC適用の費用対効果を得ることは容易でない。 |
CDASH-SDTM-ADaMの仕様書作成プロセスを連動させることによりトレーサビリティが容易に確保でき、CDISC適用に伴う追加の労力を最小化し、CDISC適用のベネフィットの最大化を助けます。 |
関連情報
CDISC対応への取り組み
CDISC(臨床試験のデータ標準)に関する富士通の取り組みや、CDISC関連発表資料や関連ソリューションのご紹介、CDISC関連ツール(Define.xml)を公開しています。