国立研究開発法人 国立がん研究センター東病院 様
安全性情報をはじめとする治験情報を電子化・一元管理し、
最先端の医師主導治験(注1)を支援するGCP(注2)マネジメントシステム
[2017年2月16日掲載]

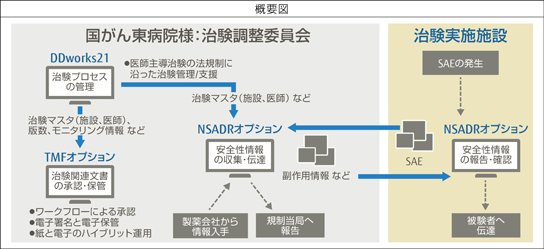
日本人の二人に一人が罹患し死因トップを占めるという「がん」に対して、国の臨床研究中核病院(注3)として世界最高レベルのがん医療の提供と新たな治療薬の創出に尽力する国立研究開発法人 国立がん研究センター東病院様(以下、国がん東病院)。医療安全の確保を図り、より良い医師主導治験環境の整備を目指し、治験管理業務支援システム「FUJITSU ライフサイエンスソリューション tsClinicalDDworks21」(以下、DDworks21)(注4)シリーズの安全性情報の伝達管理システム「tsClinical DDworks21/NSADR」(以下、NSADR)(注5)と、治験文書管理システム「tsClinical DDworks21/TMF」(以下、TMF)(注6)を組み合わせた新GCPマネジメントシステムを構築されました。各治験施設と迅速かつ正確な安全性情報の収集・伝達と確認、治験関連文書の電子化と保管、電子署名による承認ワークフローなどを実現するため、富士通は、新たな仕組みづくりに貢献しました。
【課題と効果】
| 導入前の課題 | 導入後の効果 | |
|---|---|---|
| 医師主導治験において、各治験施設との安全性情報の収集と伝達をいち早く、より確実に実施したい。 |
|
NSADRの導入により安全性情報の一元管理が可能になり、各治験施設と安全性情報の迅速な収集・伝達を実現。医療安全を確保しながら、医師主導治験のGCPマネジメントが可能に。 |
| 治験関連文書を作成し、プリントアウトしたものを回送して、責任者の承認を得るため、手間と時間がかかる。また各治験施設からメールなどで入手した文書ファイルの整理にも手間がかかっている。 |
|
TMFのワークフローと電子署名を活用することで、今後、迅速な治験関連文書のレビューと承認、また電子保管と一覧化が期待できる。また各治験施設から入手した紙文書や電子ファイルも一元管理が可能に。 |
被験者の安全を確保し、迅速かつ質の高い
医師主導治験を実現する新たな仕組みを構築
日本に8つしかない臨床研究中核病院(2016年12月現在)は、「新たな薬や医療技術の研究開発」という大きな使命を担っています。なかでも国がん東病院は、未承認抗がん剤の医師主導治験を国内で初めて立ち上げるなど、より良いがん医療を目指して世界的にも最先端の研究を推進しています。

副院長(研究担当)
先端医療科長
土井 俊彦 様

臨床研究支援部門
部門長
佐藤 暁洋 様
「医師が自ら治験を行う医師主導治験は、世界レベルでのがん医療の創出に、重要な役割を果たします」。そう語るのは副院長の土井俊彦先生です。2015年の医療法改正に伴い臨床研究中核病院として承認を受け、医療安全を確保しながら、よりスピード感のある質の高い医師主導治験のGCPマネジメントの仕組みづくりを進めるべく、NSADRとDDworks21、TMFの三位一体による新システムの構築プロジェクトが始動しました。他施設共同の医師主導治験では、副作用等の安全性情報を、治験調整委員会(治験調整医師と治験調整事務局で構成)が取りまとめて、各施設の「自ら治験を実施する者(治験責任医師)」に伝達します。そして各施設の「自ら治験を実施する者」の見解を基に規制当局へ報告します。
「医師主導治験はFIH(世界初のヒトへの投与)となる未承認薬も扱います。一刻も早く治験の現場に副作用情報等を提供し、被験者の安全を担保できる仕組みをつくりたいと願っていました」(土井先生)。
医師主導治験の支援部門のリーダーである佐藤暁洋先生は、各治験施設で発生した重篤な有害事象(以下、SAE注7)や治験薬提供元の製薬会社からもたらされる海外の安全性情報を、紙文書やメールなどの人手を介して管理する従来の手順から見直すことを検討していました。「『安全性情報の収集・伝達』をより確実かつ迅速に実施すべくNSADRを採用し、併せて治験情報をDDworks21で一元管理することにしました。特に各治験施設で発生したSAEを確実かつスムーズに収集・管理する、これまでにないシステムをつくりましょうという富士通さんの提案は、他の医師主導治験の良きモデルにもしたいという我々の想いに合致していました」。
迅速かつ法令を遵守した、安全性情報管理と治験文書の電子化

臨床研究支援部門
研究企画推進部
安全管理室長
米村 雅人 様

臨床研究支援部門
研究企画推進部
システム管理室長
青柳 吉博 様

臨床研究支援部門
研究企画推進部
研究推進室長
福谷 美紀 様

臨床研究支援部門
研究企画推進部
システム管理室
柳沢 由布子 様
医師主導治験の新たなモデル化も見据えた新システムだけに、安全性情報の管理は迅速さだけでなく、GCPを遵守するという信頼性保証の観点も不可欠です。
「より確実でスピード感ある伝達や保管に加え、システムで一つの型にはめて体系化できれば、様式の違いやハンドリングのばらつきもなくなり、情報の質も精度も高まると考えました」と語る安全性情報管理担当の米村雅人氏。
「各治験施設からSAE報告書を単にメールのように送信するだけのシステムでなく、過去に報告したSAEを一覧化し、追加報を出す場合は過去の報告内容を参照しながら新たなSAE報告書を登録できるようにすることで『継続的にわかりやすく記録を残せる仕組みを』とのご要望に応えることができたと思っています」と富士通・谷宏嗣も振り返ります。また、治験文書の電子署名によるワークフローと電子保管の実現にむけて導入したのがTMFです。「承認申請の電子化にもつなげる第一歩と考えていたので、治験関連文書を電子化するためのTMFの提案もよかったですね」とIT管理を統括する青柳吉博氏。
「紙文書の運用をワークフローでの電子承認に切替えるには、標準業務手順書の見直しやすべての関係者への周知など、調整すべき事柄が多くあります。しかし紙でプリントアウトし、土井先生に承認の署名をいただいて…と、今まで時間のかかっていた業務が、ペーパーレスのワークフローと電子署名で瞬時に済むことには期待しています」と治験調整事務局の福谷美紀氏。
さらに電子カルテ、治験原データ管理など、国がん東病院の様々なシステムをサポートしてきた富士通は今回、各治験施設の利用者がスムーズに運用開始できるように、教育用動画や操作マニュアル、クライアント設定手順などをまとめた導入キットを作成し、国がん東病院や治験施設に提供しました。「難しく感じがちなクライアント展開や教育の不安も解消され、システム管理者としても助かっています」(IT管理担当の柳沢由布子氏)。
さらに最適化させ、時間はかかっても
医療現場の新たなプラットフォームに
「本格的な運用はこれからです。成果が正しく評価されるのは10年後でしょうね。電子カルテも本当の意味で活用するには時間がかかりましたから。また製品のリリース後も、ユーザの要望を取り入れながら機能改善を続ける富士通さんの姿勢は頼もしく思っています。TMFとNSADR間の連携強化や、さらなる操作性の向上などにも期待しています」と青柳氏。その言葉に頷きながら土井先生が展望を語ります。
「今後、今回構築したGCPマネジメントシステムを医師主導治験に最適化し、特定機能病院などにも活用できるプラットフォームにしていけたらと思います。本来、安全性情報の管理は、医療行為で生じるイレギュラーを集約し『次に、同じことをしない』ための仕組みです。また、病院長や治験責任医師が交代しても治験関連文書の管理を継続する必要もあります。今後、このようなシステムがますます求められていくはずです」。
富士通は2017年春、TMFの新しい機能として、治験関連文書を治験依頼者と治験施設との間で電子授受する機能をリリースする予定です。富士通・上杉稔は「国がん東病院をはじめ、日本の医療現場、新薬開発の一端を担えるよう、今後も取り組んでまいります」と抱負を語ります。
「より良い医療・新薬開発のためのニーズを我々と富士通さんで情報共有し、新たな医療プラットフォームを実現できれば嬉しいですね」(土井先生)。

国立研究開発法人 国立がん研究センター東病院の皆様と、富士通のプロジェクトメンバー
| (注1) | 製薬会社が主導する企業治験とは異なり、国内未承認薬や適用外使用などの承認申請を目的に医師が自ら実施する治験 |
| (注2) | Good Clinical Practice/医薬品の臨床試験の実施の基準に関する省令 |
| (注3) | 日本発の革新的医薬品・医療機器の開発などに必要となる質の高い臨床研究を推進するため、国際水準の臨床研究や医師主導治験の中心的役割を担う病院 |
| (注4) | 治験管理業務支援システム。治験の実施計画立案から終了手続きまで、GCP管理系業務全般をサポートする。製薬業界のデファクトスタンダードとなる導入実績がある |
| (注5) | 副作用などの安全性情報の通知伝達、受領状況確認、責任医師判断結果の収集などを一元管理するオプションシステム |
| (注6) | 治験関連文書の電子保管と一覧化、ワークフローと電子署名による文書承認などを可能にするオプションシステム |
| (注7) | Serious Adverse Event・重篤な有害事象/治験薬を投与された被験者に生じたあらゆる好ましくない医療上の出来事(当該治験薬との因果関係の有無は問わない)の中で、死亡、死亡のおそれ、入院又は入院期間の延長、障害、先天異常、これらに準じて重篤なもの |
システム全体イメージ
お客様概要
 |
|
| 名 称 | 国立研究開発法人 国立がん研究センター東病院 様 |
|---|---|
| 開 設 | 1992(平成4)年7月1日 |
| 所在地 | 千葉県柏市柏の葉6-5-1 |
| 代表者 | 院長 大津 敦 |
| 職員数 | 1,139人(医師211人、看護師425人、2017年1月1日現在) |
| 事業内容 | がん専門病院。日本のがん医療を担う専門病院のなかでも、最先端で高度ながん医療を提供するための臨床研究・医療技術の開発拠点となっている。国の臨床研究中核病院。未承認薬の医師主導治験では国内トップの実績。病床数425床 |
| URL | http://www.ncc.go.jp/jp/ncce/index.html |
事例紹介(PDF版)
以下より、PDF版の事例紹介をダウンロードできます。
事例紹介 国立研究開発法人 国立がん研究センター東病院 様 (1.24 MB )
関連情報
ご紹介した商品
お問い合せ先
富士通株式会社
西日本ビジネスグループ グローバルビジネス本部 ライフサイエンス事業部
TEL:06-6920-5758(大阪) / 03-6424-9584(東京)
E-mail:ddworks21@cs.jp.fujitsu.com
本事例中に記載の肩書きや数値、固有名詞等は取材当時のものであり、このページの閲覧時には変更されている可能性があることをご了承ください。


