富士通エフ・アイ・ピー株式会社
安全性情報の収集を支援する「Colle-Spo」に
詳細報の機能を追加
~日本初となる詳細報の収集を支援するSaaS型サービス、安全性情報収集の大幅な効率化を実現~
富士通エフ・アイ・ピー株式会社(注1)(以下 富士通エフ・アイ・ピー)は製薬企業に向けて、医薬品の副作用や感染症などの情報(以下 安全性情報)を収集するSaaS型サービス「FUJITSU ライフサイエンスソリューション tsClinical Colle-Spo(ティーエスクリニカル コレスポ)(以下 Colle-Spo)」に詳細報収集を支援する機能を追加し、2020年3月から提供開始します。詳細報の収集を支援するSaaS型サービスは日本初となります。
当社は、昨年7月から一報の収集を支援する機能を搭載した「Colle-Spo」を提供しています。今回、詳細報の収集機能として、ファーマコビジランス部門(注2)(以下 PV部門)が医薬情報担当者(以下 MR)に依頼する機能や、医師がWeb経由で副作用・感染症詳細調査票(以下 詳細調査票)に入力する機能などを新たに追加しています。また、入力した症例情報は業界標準の連携フォーマットでのダウンロードが可能となり、各社の安全性情報管理システムに取り込むことも可能です。これらの機能により、収集に携わる医師、MR、PV部門の業務負担を軽減できます。
今後も当社は、医薬品や医療機器の安全性情報管理業務を支援するソリューションの提供を通じ、安心・安全な医療の実現に貢献してまいります。
昨今の製薬業界は、薬価制度改革や後発医薬品の普及といった事業環境の変化に伴い、MRやPV部門の担当者が減少傾向にあります。一方で、医薬品の安全性への意識が国民の間で高まっていることもあり、安全性情報の報告件数は増加しています。また、薬機法(注3)、ER/ES(注4)などの各種要件を満たすためには、より確実な情報収集と記録保管、適切な報告が不可欠であり、業務の負担が増大しています。
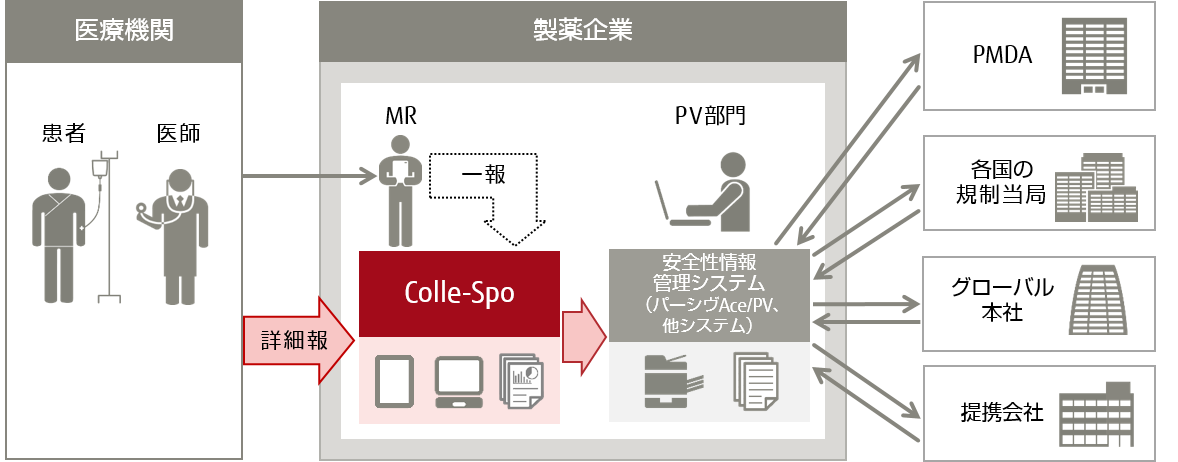
製薬企業は、医師などの医療関係者から安全性情報を入手した際、その情報を収集・評価し、独立行政法人医薬品医療機器総合機構(PMDA)へ報告することが薬機法によって義務づけられています。この情報収集には、医療機関から連絡を受け、MRが医師にヒアリングを行い、連絡票を記入する「一報」と、一報収集後、詳細な調査が必要だと判断された場合に、MRが持参した詳細調査票を医師に直接記入してもらう「詳細報」があります。
従来、詳細報の収集は、PV部門から依頼を受けたMRが医師のもとへ詳細調査票を持参し、医師が手書きで記入した詳細調査票をMRが受け取りPV部門にFAXで送付していました。これらの手間に加え、FAX送付時に詳細調査票を置き忘れるなどのリスクがありました。また、PV部門では、詳細調査票を安全性情報管理システムに手入力する作業負荷の軽減や、再調査収集などの対応の遅れや漏れの防止が課題となっていました。
今回、既に提供している一報の機能に加え、PV部門がMRに詳細調査を依頼する機能や、医師がWeb経由で詳細調査票を入力する機能など、詳細報収集のための機能を追加しています。また、業界標準の連携フォーマットであるICSR(注5)(E2B(R3)(注6)形式)でのダウンロードが可能となり、各社の安全性情報管理システムに取り込むことも可能です。これらの機能により、収集に携わる製薬企業の医師、MR、PV部門の業務負担を軽減することができます。今回の機能追加により、「Colle-Spo」は日本で初めて詳細報の収集を支援するSaaS型サービスとなります。
画面イメージ
 「Colle-Spo」サービスイメージ |
当社の製薬ソリューションについて
当社は、1995年に製薬企業に対して医薬品の安全性情報管理システム「パーシヴ」シリーズを発売し、累計80社以上の製薬企業に利用されています。また、2002年には製造販売後調査を支援するEDC(注7)サービス「FUJITSU ライフサイエンスソリューション tsClinical PostMaNet(ポストマネット)」を、2006年には製造販売後調査の進捗管理システム「FUJITSU ライフサイエンスソリューション tsClinical PostMaWatch(ポストマウォッチ)」を発売し、製薬協会員70 社のうち60%以上の企業、約360 調査に利用されています。業界トップシェアのサービスの提供を通じ、製薬企業の製造販売後調査や安全性情報管理の各業務を支援してきました。
さらに、2019年7月には、安全性情報の収集を支援するSaaS型サービス「Colle-Spo」を発売いたしました。まずは一報の収集機能を先行して提供開始しています。
特長
- Webでの情報入力
調査依頼、症例入力、回収、再調査など詳細報の収集業務を電子化します。これにより、従来紙で行っていた業務の負荷が軽減されます。また、SaaS型のサービスであるためWeb経由の利用が可能であり、入力デバイスにはパソコン(Windows、Mac OS)に加えてタブレット端末も利用が可能です。そのため、インターネット環境があれば時間や場所を問わず情報の送信が可能となります。 - 情報の一元管理
入力したデータを原本として、クラウド上に一元管理しますので、紙運用により発生する可能性がある紛失などのリスクを軽減します。また、情報収集の進捗を管理する各種機能により進捗状況の確認や期限の管理が可能となり、対応漏れや対応遅れを防止します。さらに、操作履歴や更新履歴などを正確に記録しますので、各種の監査への対応にも有効です。 - 安全性情報管理システムとの連携
入力した症例情報はE2B(R3)形式のICSRファイルでダウンロードすることが可能なため、各社の安全性情報管理システムに取り込んでデータ連携を行うことが可能です。このため、従来紙の詳細調査票を基に詳細報を手入力でシステムに取り込んでいたPV部門の大幅な業務効率化につながります。
販売価格、および提供開始時期
内容 | 販売価格(税抜) | 提供開始時期 |
|---|---|---|
| 初期費用 | 600万円から
| 2020年3月 |
| 月額費用 | 40万円から
|
販売目標
2020年度に10社、3年間で30社(一報、詳細報含む「Colle-Spo」全体で)
関連Webサイト
・安全性情報一報・詳細報収集支援サービス FUJITSU ライフサイエンスソリューション tsClinical Colle-Spo ![]()
・安全性情報管理システム FUJITSU ライフサイエンスソリューション tsClinical パーシヴAce/PV ![]()
・製造販売後調査データ収集システム FUJITSU ライフサイエンスソリューション tsClinical PostMaNet ![]()
・製造販売後調査進捗管理システム FUJITSU ライフサイエンスソリューション tsClinical PostMaWatch ![]()
商標について
記載されている製品名などの固有名詞は、各社の商標または登録商標です。
注釈
- 注1
- 注2ファーマコビジランス部門:
医薬品に関わる安全性情報を収集・管理する部門。 - 注3薬機法:
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律。2014年11月にそれまでの薬事法から名称変更とともに施行。 - 注4ER/ES:
ERは電子記録、ESは電子署名。厚生労働省はER/ES 指針を発表し、これまで紙に実施されていた記録や署名を、電子データへ置き換えるために必要となる指針としてまとめている。 - 注5ICSR:
Individual Case Safety Report(個別症例安全性報告)の略。ICH(日米欧での標準化団体)で規定された、医療現場で生じた薬物によると疑われる有害事象の標準的報告仕様。 - 注6E2B(R3):
個別症例安全性報告を電子的に伝送するためのデータ項目。 - 注7EDC:
Electronic Data Captureの略。臨床検査値などの臨床データを、インターネットを介して医療機関から電子的に収集し管理すること。 - 注8ISO/IEC27001:
ISO(国際標準化機構)が定めた、組織における情報セキュリティマネジメントシステムに関する国際規格。情報の機密性(C:Confidentiality)・完全性(I:Integrity)・可用性(A:Availability)の3つをバランスよくマネジメントし、情報の有効活用を実現するためのツール。ISMSの後継認証制度として、2005年に発行された。 - 注9ISO022301:
2012年5月15日に発行された事業継続マネジメントシステム(BCMS)の国際規格で、マネジメントシステムの要求事項を規定したもの。
本件に関するお客様のお問い合わせ先
富士通エフ・アイ・ピー株式会社 パブリックサービス推進部
![]() TEL:03-6722-0242 E-mail:fip-info@cs.jp.fujitsu.com
TEL:03-6722-0242 E-mail:fip-info@cs.jp.fujitsu.com
受付時間 8時45分~17時30分(土曜日・日曜日・祝日ほか当社休業日を除く)
プレスリリースに記載された製品の価格、仕様、サービス内容、お問い合わせ先などは発表日現在のものです。その後予告なしに変更されることがあります。あらかじめご了承ください。