医薬品安全性情報の収集から報告、保管までの一元管理を実現。
安全性情報管理システム FUJITSU ライフサイエンスソリューション
tsClinical パーシヴAce/PV

tsClinical パーシヴAce/PV(パーシヴエース/ピーヴイ)とは?
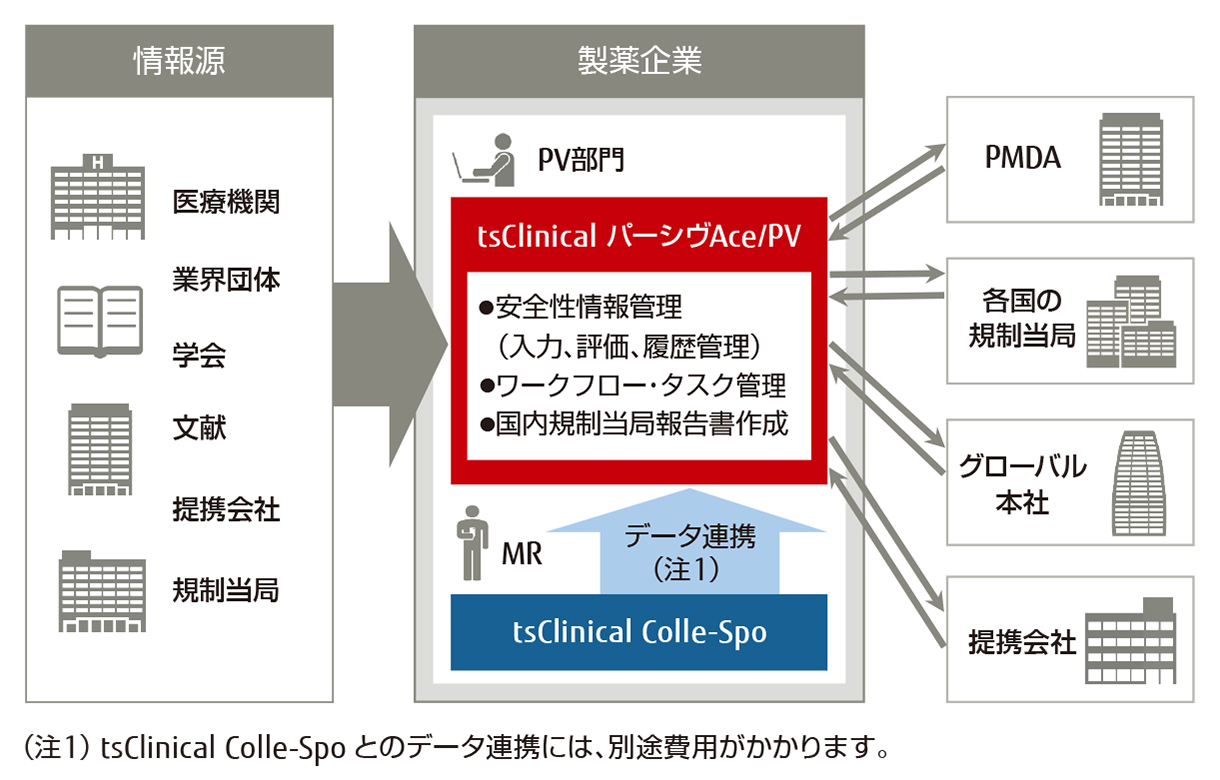
「tsClinical パーシヴAce/PV(ティーエスクリニカル パーシヴエース/ピーヴイ)」は、医薬品安全性情報の収集から報告、保管までの一元管理を実現します。各種機能により、GVP省令に基づく安全性情報管理業務の実施および業務効率化を強力にサポートします。
特長
- 入手情報ごとの版数、更新履歴の管理が可能
- 入力支援機能やチェック機能が充実
- 製造販売後調査データ収集システム「tsClinical PostMaNet」との連携が可能
- 安全性情報一報・詳細報収集支援サービス「tsClinical Colle-Spo」との連携が可能
- ER/ES (注2) 、21 CFR Part11(注3)に対応
- E2B(R3)形式の報告に対応(E2B(R2)形式での報告も可能)
- 注2平成17年4月に厚生労働省医薬食品局長から出された医薬品、医薬部外品、化粧品、医療機器の承認や許可などに関する申請・届出において、電子データや電子署名を利用する際の必要な要件を定めたガイドラインのこと。
- 注31997年にアメリカ食品医薬品局(FDA)が制定した規則で、医薬品や食品の販売許可申請の際に使用する電子データと電子署名について、遵守するべき要件を定めたもの。
機能
tsClinical パーシヴAce/PV(ティーエスクリニカル パーシヴエース/ピーヴイ)は、医薬品安全性情報の収集から報告、保管までの一元管理を実現します。各種機能により、安全性情報管理業務の規制を遵守(GVP)、業務効率化を強力サポートします。
基本機能
| 安全性情報管理 |
|
|---|---|
| 当局(PMDA)報告書類作成 |
|
| 各種帳票作成 |
|
| ワークフロー・タスク管理 |
|
| 利用者権限管理 |
|
| 監査証跡 |
|
オプション機能
| ICSR自動受信 |
|
|---|---|
| 連絡票取込 |
|
| 文献前処理 |
|
| 情報活用 |
|
| 症例ドキュメント管理 |
|
| tsClinical PostMaNet連携 |
|
| DSUR |
|
| コンビネーション製品対応 |
|
- 注4現在、連絡票取込オプションをご利用中のお客様で「tsClinical Colle-Spo」によって収集された症例データの取り込みを行うには、別途費用が必要になります。
入力画面
作業ナビゲータ
評価画面
| APサーバ クライアントサーバ型の場合(注5) |
DBサーバ クライアントサーバ型の場合(注5) |
クライアント(PC) | |
|---|---|---|---|
| OS | Windows Server 2016 Windows Server 2022 (いずれも64bit) |
Windows Server 2016 Windows Server 2022 (いずれも64bit) |
Windows 10(32bit/64bit) Windows 11(64bit) |
| DBソフト | ― | Oracle 19c(64bit) | ― |
| MSOffice製品 | (注6) | ― |
Microsoft Office Professional Plus 2016(注7) Microsoft Office Professional Plus 2021(注7) (いずれも32bit) |
| その他 | ― | ― | ディスプレイ:1280×1024以上 (1600×1200推奨)(注8) |
- 注5クラウド型のご用意もございます。詳細につきましては、お問い合わせください。
- 注6APサーバ上でシステム起動確認を行う場合、APサーバ上に、Microsoft Officeが必要となります。
- 注7Office 2016/2021を用いた場合、以前のバージョン(Office 2007/2010/2013)を用いた場合に比べ、帳票出力に時間がかかることがあります。
- 注8推奨ディスプレイ以外を利用した場合は、画面のスクロールができなくなる等の不具合が生じる恐れがあります。
お客様サポート
Q&A受付システムにてインターネット経由でお問い合わせの受付・回答をします。ただし緊急時は、電話でお問い合わせを受け付けます。
Q&A受付システム
| 6時~翌日3時 |
|
|---|
パーシヴサポートセンター
| 9時~17時30分 |
|
|---|
お問い合わせ
安全性情報管理システム tsClinical パーシヴAce/PVに関するお問い合わせ
導入をご検討されている、お客様の各種ご質問、お見積りやサービス導入のご相談などを承ります。
ぜひ、お気軽にご相談ください。後ほど、当社担当者より折り返しご連絡させていただきます。
-
WEBでのお問い合わせはこちら
当社はセキュリティ保護の観点からSSL技術を使用しております。
-
お電話でのお問い合わせ
富士通Japan お客様総合センター
0120-835-554 (通話無料)受付時間:9時~12時、13時~17時30分(土曜日・日曜日・祝日・当社指定の休業日を除く)
リリース情報
- 令和4年10月31日付けV2.1.1.0リリース(.NET Framework 4.8対応版)・ Windows Server 2022、Windows 11、Office 2021での動作確認を実施(環境の詳細は「動作環境」をご確認ください)
- 注9治験通知
- 令和3年7月30日付け薬生発0730第8号厚生労働省医薬・生活衛生局長通知「「医薬品等の副作用等の報告について」の一部改正について」
- 令和2年8月31日付け薬生発0831第8号厚生労働省医薬・生活衛生局長通知「独立行政法人医薬品医療機器総合機構に対する治験副作用等報告について」
- 令和2年8月31日付け薬生発0831第25号厚生労働省医薬・生活衛生局長通知「「医薬品等の副作用等の報告について」の一部改正について」
- 令和2年8月31日付け薬生薬審発0831第12号・薬生安発0831第3号厚生労働省医薬・生活衛生局医薬品審査管理課長・医薬安全対策課長連名通知「E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告について」※令和3年7月30日 別添改正
- 令和2年8月31日付け薬機審マ発第0831001号・薬機安企発第0831003号・薬機安対一発第0831001号・薬機安対二発第0831001号・薬機品安発第0831001号独立行政法人医薬品医療機器総合機構審査マネジメント部長・安全性情報・企画管理部長・医薬品安全対策第一部長・医薬品安全対策第二部長・医療機器品質管理・安全対策部長連名通知「E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告の留意点について」※令和2年12月25日別添、別紙5一部改正 ※令和3年7月30日別添1一部改正
- 令和2年8月31日付け薬生薬審発0831第14号厚生労働省医薬・生活衛生局医薬品審査管理課長通知「治験副作用等症例の定期報告に係る留意事項について」
- 令和2年12月9日付け厚生労働省医薬・生活衛生局医薬品審査管理課事務連絡「治験副作用等症例の定期報告に関する質疑応答集(Q&A)について」
- 令和元年7月10日付け厚生労働省医薬・生活衛生局医薬品審査管理課・医薬 安全対策課連名事務連絡「E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告に関するQ&Aの改正について」※令和2年12月9日改正 ※令和3年7月30日改正
- 注102017年11月追加通知
- 平成29年11月28日付け薬生薬審発1128第5号・薬生安発1128第4号厚生労働省医薬・生活衛生局医薬品審査管理課長・厚生労働省医薬・生活衛生局医薬安全対策課長通知「「安全性定期報告書別紙様式及びその記載方法について」の一部改正について」
- 注112017年3月追加通知
- 平成29年3月31日付け薬機審マ発第0331001号・薬機安一発第0331001号・薬機安二発第0331002号独立行政法人医薬品医療機器総合機構審査マネジメント部長・安全第一部長・安全第二部長通知「E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告の留意点について」
- 平成29年3月31日付け薬生薬審発0331第6号・薬生安発0331第1号厚生労働省医薬・生活衛生局医薬品審査管理課長・安全対策課長通知「E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告について」
- 平成29年3月31日付け厚生労働省医薬・生活衛生局医薬品審査管理課・安全対策課連名事務連絡。「E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告に関するQ&Aについて」
- 注122016年3月追加通知
- 平成28年3月31日付け薬機審マ発第0331001号・薬機安一発第0331002号・薬機安二発第0331001号独立行政法人医薬品医療機器総合機構審査マネジメント部長・安全第一部長・安全第二部長通知「市販後副作用等報告及び治験副作用等報告の留意点について」
- 平成28年3月31日付け薬生審査発0331第4号・薬生安発0331第9号厚生労働省医薬生活衛生局審査管理課長・安全対策課長通知「E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告について」
- 平成28年3月31日付け薬生発第0331第4号厚生労働省医薬生活衛生局長通知「「医薬品等の副作用等の報告について」及び「独立行政法人医薬品医療機器総合機構に対する治験副作用報告について」の一部改正について」
- 注132015年2月追加通知
- 平成27年2月16日付け薬機審マ発第0216001号・薬機安一発第0216001号・薬機安二発第0216001号独立行政法人医薬品医療機器総合機構審査マネジメント部長・安全第一部長・安全第二部長通知「市販後副作用等報告及び治験副作用等報告の留意点について」
- 平成27年2月16日付け薬食審査発0216第1号・薬食安発0216第2号厚生労働省医薬食品局審査管理課長・安全対策課長通知「「E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告について」の一部改正について」




