PRESS RELEASE
2016年12月9日
富士通エフ・アイ・ピー株式会社
「パーシヴAce/PV」として初の「ICH E2B(R3)」様式による症例報告を実施
~60社以上の導入実績を誇る安全性情報管理システム、丸石製薬様の症例報告を支援~
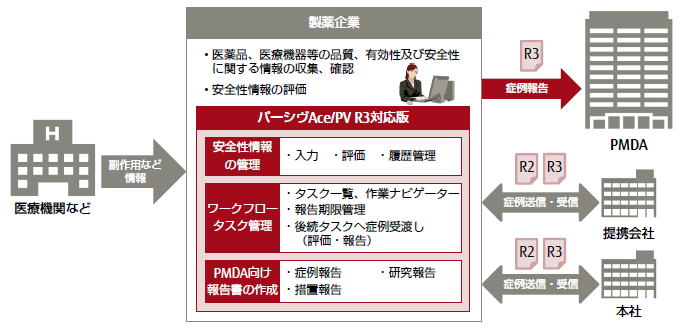
富士通エフ・アイ・ピー株式会社(注1)(以下 富士通エフ・アイ・ピー)は、医薬品の安全性情報管理システム「FUJITSU ライフサイエンスソリューション tsClinical パーシヴAce/PV(ティーエスクリニカル パーシヴエース/ピーヴイ)」(以下 パーシヴAce/PV)の「ICH E2B(R3)(以下 R3)」対応版を丸石製薬株式会社(注2)(以下 丸石製薬)様に提供し、この度、「パーシヴAce/PV」としては初となる、R3のガイドラインに基づく様式(以下 R3様式)での症例報告が行われたことをお知らせいたします。
丸石製薬様の「パーシヴAce/PV」R3対応版は10月24日から稼働しており、独立行政法人医薬品医療機器総合機構(以下 PMDA)に対してR3様式で症例報告を行い、本日まで問題なく受理されています。
当社は今後も、製薬企業が円滑にR3様式による症例報告を行えるよう支援していくとともに、医薬品や医療機器の安全管理業務を支援するソリューションの提供を通じ、より安心安全な医療の実現に貢献してまいります。
背景
製薬企業は、副作用や感染症によるものと疑われる症例などを知った際は、薬機法(注3)の規定により、定められた期限内にPMDAに対して症例として報告する必要があります。PMDAへは、医薬品規制調和国際会議(以下 ICH) (注4)で定められたE2B(注5)での症例報告が義務づけられています。従来は、「ICH E2B(R2)(以下 R2)」のガイドラインに基づく様式(以下 R2様式)が用いられてきました。
富士通エフ・アイ・ピーは、医薬品の安全性情報管理システムにおける「パーシヴ シリーズ」の発売を1995年に開始し、その後、2003年にR2様式に対応しました。これまで丸石製薬様をはじめ、60社以上の製薬企業に利用されています。
しかしR2は、世界規模でのより詳細な安全性情報の収集を考慮すると、汎用性に乏しかったため、ICHが全面的に見直したR3へと改訂を行いました。この改訂に対して厚生労働省は2013年9月に、原則としてPMDAに対しR3様式での症例報告を義務づける通知(施行開始:2016年4月1日、経過措置終了:2019年3月31日)を出しました。
これを受け富士通エフ・アイ・ピーは、R3様式での正確な症例報告が実現できるよう、日本国内におけるR3の有識者にヒアリングを行い仕様の検討を重ねるなど、いち早くR3対応に向けた取り組みを開始し、2016年3月にR3対応版の販売を開始しました。そしてこの度、「パーシヴAce/PV」R3対応版を提供した丸石製薬様で、同システムとしては初めてとなるR3様式の症例報告を行い、問題なく受理されています。
「パーシヴAce/PV R3対応版」の特長
- R3様式の症例報告に完全に対応
2016年3月に通知された仕様変更(注6)に対応しています。また、2016年11月のデータ項目のチェックルールにおける仕様変更にも対応するなど、今後の通知や仕様の変更に対しても、迅速に対応する体制を整えています。
- R2様式での症例情報の送信・受信も可能
R3にまだ対応していない提携会社や本社などとの症例情報の受け渡しには、R2様式での送信、受信が可能です。
- 日本人スタッフによるヘルプデスク
システムの入力方法だけでなく、報告様式自体に関する問い合わせに対しても、富士通エフ・アイ・ピーの日本人スタッフによるヘルプデスクが丁寧にサポートします。
- 従来の機能を継承
入手情報ごとの版数・更新履歴管理や入力支援など「パーシヴAce/PV」の従来の機能はそのまま利用できます。すでに「パーシヴAce/PV」を利用している製薬企業であれば、情報入力から報告までの業務フローを変えることなく運用が可能です。
- 最短2か月 での導入が可能
当社が提供するクラウド基盤を利用することで、最短2か月での導入が可能です。
関連リンク
- 安全性情報管理システム FUJITSU ライフサイエンスソリューション tsClinical パーシヴAce/PV
商標について
記載されている製品名などの固有名詞は、各社の商標または登録商標です。
注釈
- 注1 富士通エフ・アイ・ピー株式会社:
- 本社:東京都港区、代表取締役社長:米倉 誠人
- 注2 丸石製薬株式会社:
- 本社:大阪府大阪市鶴見区、代表取締役社長:井上 慶一
医療用消毒薬、吸入麻酔剤・鎮静剤などの医薬品の製造及び販売を行う、1888年創業の製薬会社。患者のQOL(quality of life)向上を目的として、侵襲を伴う治療や疾病による疼痛を和らげる麻酔および手術関連医薬品や、医療従事者と患者にとって最適な衛生環境創りに役立つ殺菌・消毒剤の研究・開発を積極的に進めている。
- 注3 薬機法:
- 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和35年法律第145号)。
- 注4 ICH(International Council for Harmonization of Technical Requirements for
Pharmaceuticals for human use:医薬品規制調和国際会議): - 1990年に設立された日米 EU 医薬品規制調和国際会議を基礎として、2015年に新たに法人として設立された組織。日本、米国、EU、スイス、カナダの規制当局と各国の製薬業界団体のほか、オブザーバーとしてWHO及びIFPMA(国際製薬団体連合会)などが参加して、新医薬品の品質・有効性・安全性の評価等に係る技術的なガイドラインを作成するなど、各国の規制の標準化等に貢献している。
- 注5 E2B:
- 個別症例安全性報告を電子的に伝送するためのデータ項目。
- 注6 2016年3月に通知された仕様変更:
-
- 市販後副作用等報告及び治験副作用等報告の留意点について
(平成28年3月31日 薬機審マ発第0331001号、薬機安一発第0331002号、薬機安二発第0331001号) - E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告について
(平成28年3月31日 薬生審査発0331第4号、薬生安発0331第9号) - 「医薬品等の副作用等の報告について」及び「独立行政法人医薬品医療機器総合機構に対する治験副作用報告について」の一部改正について
(平成28年3月31日 薬生発第0331第4号)
- 市販後副作用等報告及び治験副作用等報告の留意点について
本件に関するお問い合わせ先
富士通エフ・アイ・ピー株式会社 民需第四統括)第二営業部
![]() TEL:03-5730-0739
TEL:03-5730-0739
![]() E-mail:fip-info@cs.jp.fujitsu.com
E-mail:fip-info@cs.jp.fujitsu.com
受付時間:8時40分~17時30分(土曜日・日曜日・祝日ほか当社休業日を除く)
以上
プレスリリースに記載された製品の価格、仕様、サービス内容などは発表日現在のものです。その後予告なしに変更されることがあります。あらかじめご了承ください。