プレスリリース
2005年5月19日
富士通エフ・アイ・ピー株式会社
『パーシヴ/MD V1.0』の販売を開始
~日本初 医療機器製造販売業向け医療機器安全性情報管理支援システムパッケージ~
富士通エフ・アイ・ピー(株)(本社:東京都江東区、社長:太田 幸一)では、この5月より医療機器製造販売業向けに医療機器安全性情報の管理支援システム『パーシヴ/MD(Medical Devices)』を開発し、販売を開始いたしました。
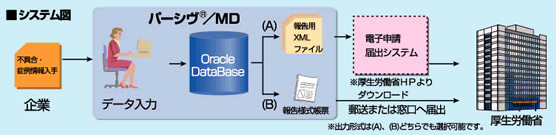
医療機器安全性情報管理支援システム『パーシヴ/MD』は、薬事法により厚生労働省への報告が義務付けられている医療機器の不具合・健康被害など安全性に関する情報の収集から報告、情報管理までの進捗管理を支援するシステムです。厚生労働省に報告するための報告様式での出力のほか、行政電子報告システムへの連動も可能なため、よりスムーズな電子報告が可能となります。
『パーシヴ/MD』は、医療機器に関する安全性情報のデータ管理の一元化とデータの活用による業務効率化により、医療機器製造販売に携わる企業の安全管理と医療機器の安全性確保を強力にご支援いたします。
医療機器は、昨今のテクノロジーの進歩と共に、より高度化・複雑化してきており、それに伴い市販後の安全対策が大きな問題となってきました。それを受け、2005年(平成17年)4月の薬事法改正の柱として「多種多様な医療機器にかかわる安全対策の抜本的見直し」「市販後安全対策の充実と承認・許可制度の見直し」が謳われています。従来、主に医薬品に適用されていた市販後調査の基準であるGPMSPに替わり、製造販売後安全管理基準(GVP)、製造販売品質管理基準(GQP)、市販後調査の実施基準(GPSP)が制定され、医療機器にも厳重に適用されることとなりました。
医療機器を製造販売する企業は、この薬事法改正を受け、市販後安全対策に関しては、GVPに基づいて安全性情報の収集管理・安全確保対策を実施する必要があります。従来よりさらに細かく・複雑になる情報の収集管理や、厚生労働省への申請・報告に対応できる体制作りが必要となり、また、これらに係るコストは医療機器の種類の増加、不具合などの安全情報の増加に伴い年々肥大化の一途をたどると予想されます。
富士通エフ・アイ・ピーでは、1996年に製薬メーカ向け医薬品情報管理システム『パーシヴ』を発売し、現在80社(シェア率80%)にご利用いただいております。パーシヴシリーズの安全性情報管理システム『パーシヴ/AE』は、医薬品の安全性情報管理を支援するシステムです。導入により副作用情報の一元管理と報告後の進捗管理が可能で、大手製薬企業様のご利用をいただき、高い評価をいただいております。
このたび販売を開始した『パーシヴ/MD』は、富士通エフ・アイ・ピーが長年かけて培ってきたGPMSP業務に関わる知識と厚生労働省からの公開資料を基に開発しており、日本初の医療機器に対応した安全性情報管理システムです。
『パーシヴ/MD』の導入により、情報源(医療機関・薬局等からの報告、文献・学会等)からの不具合や健康被害情報の一元管理ができ、安全情報の社内調査、迅速な厚生労働省への報告書作成支援、報告後までの進捗管理が可能となります。
また、不具合、健康被害情報を一元管理することによりデータの共有とリアルタイムでの検索、集計が可能となり、医療機器ごとの不具合や健康被害を期間ごとに集計できるため、改定薬事法で提示された新様式帳票の作成支援も可能になります。
富士通エフ・アイ・ピーは、今後もITを通じて医薬品や医療機器の製造販売業界の安全管理を支援し、社会から求められている「安全で高度な医療」に寄与できるビジネスを展開してまいります。
(注)
GVP:Good Vigirance Practice(製造販売後安全管理基準)
GQP:Good Quality Practice(製造販売品質保証管理基準)
GPSP:Good Post-marketing Surveillance Practice(市販後調査の実施基準)
1. パーシヴ/MDのご紹介
パーシヴ/MDは医療機器の不具合及び健康被害の情報管理を支援するシステムです。
本システムの適用により、不具合及び健康被害の情報管理、迅速・的確な行政報告、電子報告対応、調査・報告の進捗管理等を可能にします。
- 不具合・症例情報をDB管理ができます。
不具合・症例情報をデータベース管理できます。
また、出力形式は行政の報告様式に対応しており、入力したデータを帳票に反映し、Word形式で出力することが可能です。対応している報告様式は下記の二つです。
報告様式8:医療機器不具合・感染症症例報告書
報告様式10:医療機器における研究調査報告書/外国における製造等の中止、回収、廃棄等の措置調査報告書 - 行政電子報告システムへの連動が可能です。
入力したデータを様式帳票(xml形式)に出力できます。このため、行政HP上の『申請用プログラム』へ読み込むことができ、容易な電子報告が可能となります。 - 集計帳票(ラインリスト)を出力することができます。
安全性定期報告や進捗管理にも利用可能な、集計帳票を出力することができます。 - 多様な利用シーン
外出先や自宅から、あるいはWebブラウザが使える環境であればどこからでも「利用を許可されたアプリケーションやデータ」にアクセスすることが可能です。
Windows上で保管できるすべての電子ファイル形式に対応しています。
(例 PDF、PowerPoint、Excel、Wordなど)
【パーシヴ/MDご利用イメージ図】
【パーシヴ/MDの動作環境】
| サーバ | クライアントPC | |
|---|---|---|
| 適応OS | Windows 2000 Server | Windows 2000/2003/XP |
| CPU | Pentium4 3GHz 以上推奨 | Pentium4 以上推奨 |
| メモリ | 1GB以上推奨 | 512MB以上推奨 |
| ハードディスク | 10GB以上推奨 | 10GB以上推奨 |
| その他 | Oracle(8iもしくは9i)が必要
インストール時に CD-ROMドライブが必要 |
Office 2000 かOffice2003が必要 |
2. 販売開始日
2005年5月より
3. 会社概要
富士通エフ・アイ・ピー株式会社
- 本社:東京都江東区青海2丁目45番 レインボータウン
- 社長:太田 幸一
- 設立:1977年11月28日
- 従業員:2,609名(2005年4月1日現在)
- 資本金:20億円
- 売上高:845億円 (2004年度)
- ホームページ:http://www.fip.fujitsu.com/
4. 関連情報
|
【製品&サービス】
|
5. お問い合わせ
ご不明な点は、「当社へのお問い合わせ」よりお問い合わせください。
[登録商標]
引用されたメーカ名/製品名,用語はそれぞれの会社の商標または登録商標です。
「パーシヴ」は,富士通エフ・アイ・ピー(株)の登録商標です。
以上
プレスリリースに記載された製品の価格、仕様、サービス内容などは発表日現在のものです。その後予告なしに変更されることがあります。あらかじめご了承ください。
