Archived content
NOTE: this is an archived page and the content is likely to be out of date.
솔루션 특징
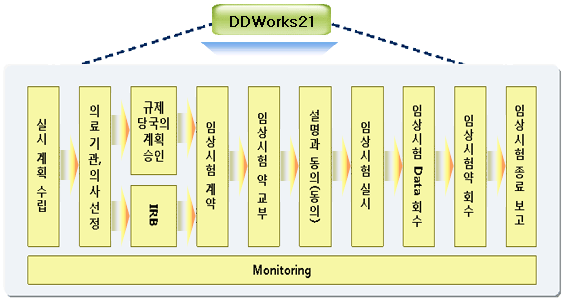
제약사의 의약품 개발 과정에서 임상시험의 Process를 Guideline인 GCP에 준해서 실시할 수 있도록 Support하는 Package입니다.
GCP 업무의 최적화 지원
한국 임상시험 환경에 대응한 Monitoring Checklist를 표준지원하며, Protocol별로 Check항목의 추가가 가능합니다. [Pre-Study, Initiation, Visit, Close-out]의 4가지 Report 작성이 가능합니다. 또한 Part11에 따른 Report의 전자화도 가능합니다.
풍부한 경고기능에 의한 KGCP에 맞춘 임상시험진행 가능
KGCP위반을 리얼타임으로 확인이 가능하며, KGCP에 맞춘 임상시험을 정확하고 유연하게 진행할 수 있습니다.
시기 적절한 진척확인 가능
임상시험 전체 및 Subject진척상황, SAE의 발생 상황 등 관리자에게 필요한 정보를 화면 및 Excel 등의 장표로 시기 적절하게 확인이 가능합니다.
FDA의 21 CFR Part11 대응
고도의 Security기능, Audit Trail 기능, 전자서명 기능 등 Part11이 요구하는 시스템 기능이 준비되어 있습니다. 시스템 도입 시 필요한 Computerized System Validation 대응에 필요한 Document의 표준 템플릿을 보유, 귀사 Policy에 적용시킴으로써 대응이 가능합니다.
사용자 편의 Web Interface 실현
사용자의 입장에서 사용하기 쉬운 인터페이스를 Web시스템으로 실현하여 시스템 운용이 용이합니다. 또한 자사의 VPN등을 이용한 외부로부터의 이용도 가능합니다.
DDworks21이 지원하는 임상업무