-
データインテグリティ対応への取り組み
- 製薬業界のデータインテグリティとは
- CDISC対応への取り組み
- MRの将来性と「地域包括ケアシステム」
- ホワイトペーパー
- ソリューションのご紹介
- 導入事例
- イベント・セミナー
- お問い合わせ
- 過去のお知らせ
製薬業界における
データインテグリティ(Data Integrity:DI)とは?
米国FDAや欧州EMAをはじめとした規制当局は、データインテグリティ(Data Integrity:DI)に焦点をおいた監視を強化し、そのためのガイダンスを 続々と発表しています。データ管理の厳格化が求められるなか、日本の製薬業界においても、データインテグリティへの対応は急務です。
データインテグリティ(Data Integrity)とは?
データインテグリティとは、情報処理などの分野で使われる用語で、データ(ソースデータ:原資料)がすべて揃っていて、欠損や不整合がないことを保証することを意味します。
製薬業界におけるデータインテグリティでは、FDAやEMAが提示する『ALCOA原則』および『CCEA』に則ったデータであることが求められています。
【データインテグリティとは】
- データが完全で一貫性があり、正確であること。ALCOA原則に則ったデータであること(FDA : 米国医薬品食品局)(注1)
- 全てのデータが、ライフサイクルを通じて完全で一貫性があり正確であること(MHRA : 英国医薬品・医療製品規制庁)(注2)
【ALCOA原則】
- Attributable(帰属性):
データの所有者・帰属・責任が明確であること - Legible(判読性):
データが判読でき、理解できること - Contemporaneous(同時性):
データの生成と記録が同時であること - Original(原本性):
データが原本であること・複製や転記ではないこと - Accurate(正確性):
データが正確であること
EMAではさらに【CCEA原則】が求められる。 - Complete(完全性):
データが完全であること - Consistent(一貫性):
データが一貫して矛盾がないこと - Enduring(耐久性):
データが永続的であること - Available when needed(必要時の有用性):
データが必要なときに利用可能であること
(注1)出典:「Data Integrity and Compliance With CGMP Guidance for Industry」2016.4 FDA
![]() https://www.fda.gov/downloads/drugs/guidances/ucm495891.pdf
https://www.fda.gov/downloads/drugs/guidances/ucm495891.pdf![]()
(注2)出典:『MHRA GxP Data Integrity Definitions and Guidance for Industry』MHRA 2016.7
![]() https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/538871/MHRA_GxP_data_integrity_consultation.pdf
https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/538871/MHRA_GxP_data_integrity_consultation.pdf![]()
データインテグリティ(Data Integrity)への対応のポイント
データインテグリティは、データの生成から廃棄に至るまでの、データのライフサイクルの全過程で担保されるべきものです。すなわち、所属部門や業務の種別に関係なく、全社的に取り組みむべき課題となります。
データのライフサイクル
データインテグリティを担保するためには、データのライフサイクル全般を、全社的・部門横断的に、かつ、ガバナンスや品質にも配慮した管理をする必要があります。

【データのガバナンス】
- データに関連する情報を業務横断的に管理
- 実データとともにメタデータ(誰が・いつ・どのように・データを生み出したのか、権限設定や業務SOPの組織プロセス情報)の管理
【データの品質】
- データインテグリティ確保のためのリスクアセスメント、コントロール、定期的監視
製薬業界における
データインテグリティ(Data Integrity)への取り組み
なぜ、製薬業界でデータインテグリティが求められているのか?
医薬品の安全性の追及は、製薬業界において必須事項です。一方で、医薬品申請の電子化に伴いデータインテグリティ担保に関する指摘が多発しています。例えば、欧米の場合、当局が発信する査察指摘事項(Warning Letter)の60%がデータ管理不備を指摘するものとなっています。
国際標準化が進む製薬業界において、グローバル化・電子化に対応するためには、データインテグリティへの取り組みは急務です。
【医薬品の安全性追及】
- ヒトへの投与時の安全性、個別化医療の進展、偽薬問題、ジェネリックの品質問題
【医薬品ライフサイクルに関する電子化の発展】
- 国際標準化の発展を背景にプロセス全体への電子化対応が進展
【エビデンス重視の査察対応強化】
- 上記の流れを踏まえて規制当局が査察を強化
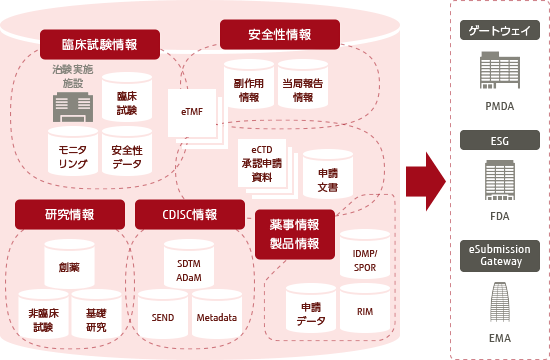
医薬品ライフサイクルにおける電子データの流れ
製薬業界におけるデータインテグリティでは、創薬研究段階から、非臨床、臨床、申請、製造販売後、PV(Pharmacovigilance: 医薬品安全性情報管理)を含めた「医薬品のライフサイクル」で生成されたすべてのデータが対象となります。
それには、Rawデータや原資料だけでなく、メタデータ(誰が・いつ・どのように・データを生み出したのか、権限設定や業務SOPの組織プロセス情報)や関連文書、関連データなど、医薬品使用の根拠となるすべてのエビデンスデータが含まれます。
富士通のデータインテグリティ(Data Integrity)ソリューション
富士通は、30年以上、製薬業界の皆さまのためのサービスを提供し続けてまいりました。創薬から申請・販売まで、製薬業界のプロセスを熟知しているコンサルタントがサポートいたします。お気軽にご相談ください。